第四届全国肌骨影像高峰论坛于2023年4月9日在重庆圆满落幕,此次论坛中复星医药美中互利深度参与,于4月8日举办新技术论坛之EOS全身骨骼三维建模成像系统临床应用论坛。
此次美中互利分论坛由中华医学会放射学分会骨组副组长、北京积水潭医院放射科主任科程晓光教授担任大会主席,解放军总医院第四医学中心放射科主任李天然教授担任学术点评,西安市红会医院放射科主任汤永刚教授、广州医科大学附属中医医院放射科主任柏瑞教授、西安市红会医院关节外科主任李辉教授、深圳市第二人民医院脊柱健康中心陆昕海教授、EOS imaging亚太区负责人刘江龙博士五位讲者分别进行了专题讲座,从不同角度阐释了EOS的这项新技术的临床及科研价值。
在有限的时长中,五位专家讲者从临床不同角度出发,分享了EOS这一先进性检查手段的临床应用价值与最新研究进展。同时,现场来宾踊跃参与讨论,现场气氛积极热烈。

开场致辞
会议首先由大会主席中华医学会放射学分会骨组副组长、北京积水潭医院放射科主任科程晓光教授致开幕辞。程主任指出,积水潭医院作为EOS国内最早的一批用户,在多年的使用过程中深刻感受到了其巨大的临床价值,同时程主任认为这一设备值得在国内大力推广,也希望借助此次新技术论坛能让更多的医院以及临床医生对这一新技术有更进一步的了解。

来自复星医药美中互利医疗的CEO李艳女士代表公司全体员工为会议做了欢迎致辞。她指出,美中互利医疗自1981年成立至今,在中国已经走过了41个年头。在这期间也创造了很多个“第一”,希望未来可以多举办此类会议,为EOS的使用者和关注者提供一个学术交流的平台。

学术分享
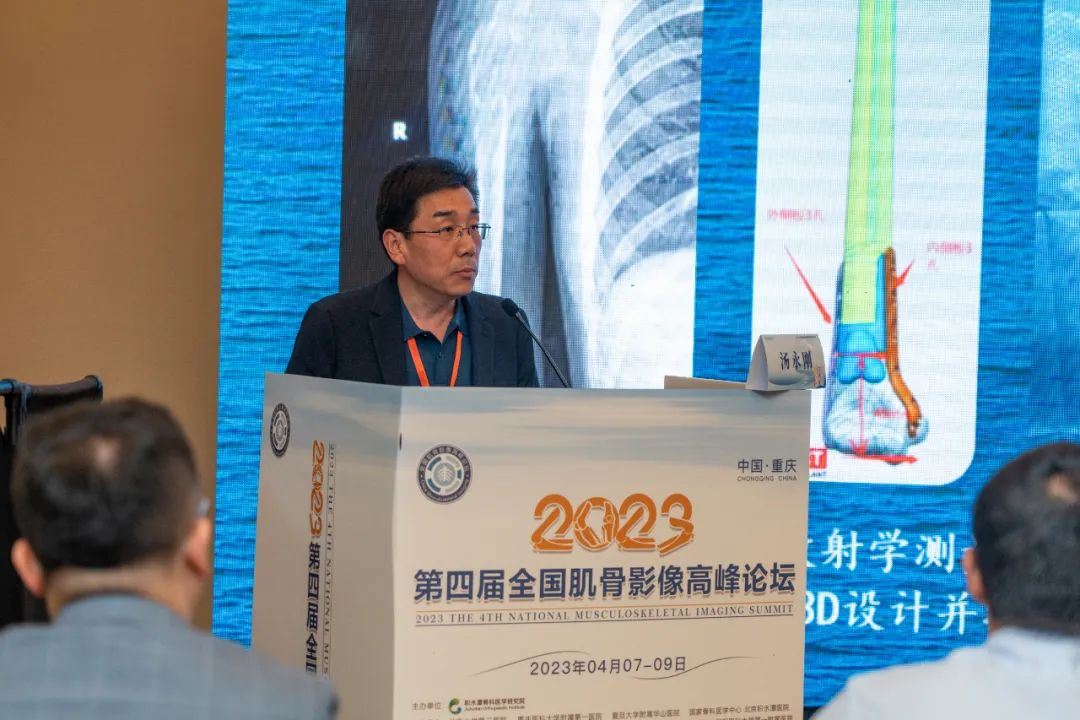
学术分享环节首先由西安市红会医院放射科主任汤永刚教授带来题为《放射学测量之临床应用与创新》的专题讲座。西安红会医院在全球EOS装机用户中,设备利用率遥遥领先,积累了丰富的临床经验。汤教授从设备设计原理角度阐述了EOS的精准性,因此为精准医疗提供了有利的支撑和保障,为患者的诊疗方案的制定与术前评估提供了可靠的依据。
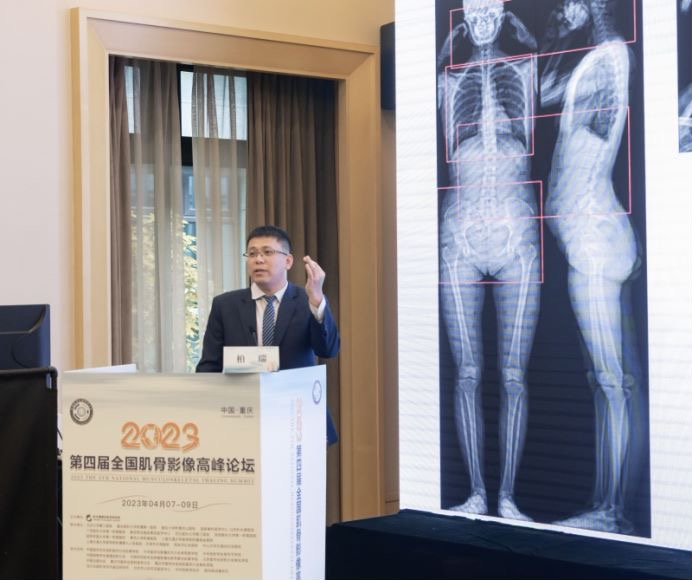
随后广州医科大学附属中医医院放射科主任柏瑞教授带来的题为《EOS-只为骨科影像而生?》的专题讲座。以生动详实的病例,展示了EOS除了在脊柱、下肢、全身姿态评估外,在包括骨盆盆地康复治疗、骨龄评估以及一站式体检成像中都具有重要临床价值,拓展了临床应用的方向和领域。

西安市红会医院关节外科主任李辉教授随后带来的讲座题为《髋关节假体个性化安全区的确立》。从骨科的角度,肯定了EOS对于指导手术以及术前评估中所发挥的作用,EOS的应用,有利于科学精准的指导手术方案的制定,从而改善患者预后,提高其术后生活质量。

深圳市第二人民医院脊柱健康中心陆昕海教授所做的《医学影像在AIS筛查中的应用》专题讲座,而是从康复治疗的角度讲解了EOS及三维建模的临床价值,并用全面生动的病例分析了EOS的在深圳市学生脊柱侧弯校园筛查项目中的应用进展。

第五位讲者是来自EOS imaging亚太区负责人刘江龙博士的题为《EOS肌骨影像解决方案的应用前景》,刘博士详实、具体阐述了EOS各大解决方案的临床价值以及国内外应用情况,进一步拓展了EOS在未来的应用方向。

在五位专家讲者精彩的主题演讲后,与会嘉宾对EOS的临床应用进行了更为深入的讨论。正如点评专家李天然教授所说,EOS是非常值得期待的一个全身骨骼影像检查新工具,希望通过不断的交流沟通,逐步提升临床以及放射科医生对于该设备的认知,最终造福广大骨科疾病患者。

值得一提的是,近年来,随着医学影像技术的飞速发展,新的检查手段日益涌现,EOS作为骨科影像新技术的代表在骨科疾病诊断、治疗评估及预后的全过程中提供了一体化成像的新标准。
很遗憾,除非制造商在中国设有具有资质的分支机构来处理注册问题,否则这是不合法的且不合规的,进而,海外制造商必须指定中国代理人进行医疗器械注册。
对于NMPA注册费,进口医疗器械第二类医疗器械注册费为21.09万元,第三类医疗器械注册费为30.88万元。此外,还应考虑其他可能的费用,例如文件翻译费、临床试验费等。
注册材料经国家药监局受理后,第二类医疗器械技术审评需要60个工作日,第三类医疗器械技术审评需要90个工作日。国家药监局要求补充材料的,生产企业有义务在一年内提交,否则可能终止评审。
有 CE 或 FDA 证书的医疗器械可以在没有 NMPA 注册证的情况下进入特别行政区。对于大湾区和海南省作为试点地区,在香港或澳门已上市的医疗器械,经当地政府批准,试点地区定点医疗机构愿意采购临床急需医疗器械的,可进入试点地区。
京ICP备11010059号-1  京公网安备11010502035116号 (京)网药械信息备字(2023)第 00034 号 版权所有©澳门新葡萄新京6663
京公网安备11010502035116号 (京)网药械信息备字(2023)第 00034 号 版权所有©澳门新葡萄新京6663
京公网安备11010502035116号